los isomeros conformacionales
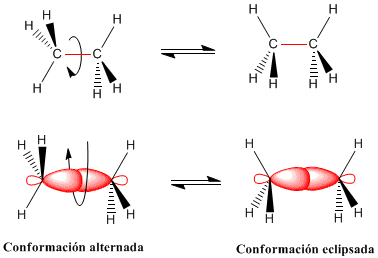
Los enlaces simples entre átomos tienen simetría cilíndrica y permiten la rotación de los grupos que unen. Las diferentes disposiciones espaciales que adoptan los átomos como consecuencia de la rotación en torno al enlace se llaman conformaciones. Una conformación concreta de las múltiples posibles se denomina confórmero.
La rotación del enlace carbono-carbono en el etano da lugar a dos conformaciones límite -la conformaciones alternada (con los hidrógenos alternados) y la conformación eclipsada (con los hidrógenos enfrentados-. El paso de la conformación alternada a la eclipsada o viceversa se realiza por giro de 60º. Obsérvese que en un giro de 360º existen infinitas conformaciones posibles.
La rotación en torno al enlace simple oxígeno-oxígeno en la molécula de agua oxigenada genera tres conformaciones de especial importancia. La conformación que tiene los hidrógenos enfrentados se llama SIN. Cuando los hidrógenos se sitúan a lados opuestos se habla de confórmero ANTI.
Isomeros conformacionales de anillo
Se presentan en reflexión de los enlaces


Isomeria configuracional geométrica (cis-trans)
La isomería cis-trans o geométrica es debida a la rotación restringida entorno a un enlace carbono-carbono. Esta restricción puede ser debida a la presencia de dobles enlaces o ciclos. Así, el 2-buteno puede existir en forma de dos isómeros, llamados cis y trans. El isómero que tiene los hidrógenos al mismo lado se llama cis, y el que los tiene a lados opuestos trans.
Los compuestos cíclicos, debido a su rigidez, también presentan isomería geométrica. Así, el 1,2-dimetilciclohexano puede existir en forma de dos isómeros. Se llama isómero cis el que tiene los hidrógenos al mismo lado y trans el que los tiene a lados opuestos.

No hay comentarios.:
Publicar un comentario